Ежегодно инвестиции в исследования и разработку новых лекарственных препаратов в мире превышают $100 млрд. Клинические исследования — наиболее ресурсоемкий этап разработки лекарства, на них приходится около 43% общего бюджета, вложенного в разработку, тестирование, регистрацию препарата и дальнейшее выведение его на рынок, пишет издание "Топ-100. Крупнейшие медицинские компании Украины".
"Фармкомпания не имеет права сама проводить исследования, поэтому вынуждена обращаться к посредникам, так называемым CRO (Contract Research Organization), — объясняет аналитик компании Pro-Consulting Андрей Цилицкий. — Это вынужденная мера для того, чтобы в дальнейшем фармпроизводителя не могли обвинить в подтасовке и умышленном изменении результатов тестирования новых препаратов".
CRO по заказу фармкомпаний проводят тестирования лекарств и после всех необходимых этапов передают результаты компании-заказчику и параллельно в государственные органы для регистрации препарата.
Многомиллионный рынок
Эпоха современных клинических исследований в Украине началась с признания в 1996 году стандартов GCP. За минувшие 20 лет количество проводимых в нашей стране клинических испытаний выросло в разы. Так, по данным Государственного экспертного центра Министерства здравоохранения Украины, если в 1996 году ведомство выдало 79 позитивных заключений о проведении клинических испытаний, то в 2015-м — 202 (максимальным этот показатель был в докризисном 2007 году — 283). Из них в прошлом году 144 исследования проводились в рамках клинических испытаний медпрепарата сразу в нескольких странах.
"В конце 2015 года в Украину начали вновь проводить долгосрочные клинические испытания, в которых принимают участие большое количество медицинских центров, что радует", — подчеркивает Антонина Смолина, координатор Подкомитета по клиническим исследованиям Европейской Бизнес Ассоциации (ЕБА).
CRO по заказу фармпроизводителей проводят тестирования лекарств и после всех необходимых этапов передают результаты компании-заказчику и параллельно в госорганы для регистрации препарата
Вместе с тем кризис не обошел стороной и этот рынок. В 2015 году количество проводимых в Украине клинических испытаний сократилось на 25% — с 269 в 2014 году. В основном это произошло за счет уменьшения количества международных исследований, что было лишь частично компенсировано активизацией отечественных фармпроизводителей.
"В 2015 году значительно снизилось количество исследований II фазы (более чем в четыре раза), практически не проводились исследования I фазы. Это падение количества новых проектов приводит к росту конкуренции и заставляет участников рынка снижать цены на услуги, искать способы оптимизации расходов", — сетует Юрий Лебедь, директор компании "Фармакси", занимающейся организацией и проведением клинических исследований фармпрепаратов.
Согласно оценкам компании "Фармакси", объем украинского рынка клинических испытаний достигает $300 млн, а число участников тестирования медпрепаратов составляет ежегодно по грубым подсчетам 50-60 тыс. человек. "Точное количество принимавших участие в клинических испытаниях посчитать сложно, поскольку большинство из них привлекается на этапе исследования поздних фаз (неинтервенционные и постмаркетинговые исследования), а они не требуют одобрения Государственного экспертного центра. Например, в одно из наших неинтервенционных исследований в этом году мы включили 5 тыс. пациентов, — объясняет Юрий Лебедь. — Исходя из общего количества одобренных исследований в Украине, количество пациентов составляет 50-60 тыс. человек в год".
Не made in Ukraine
В Украине работает около 40 компаний, сертифицированных для проведения клинических исследований. Большинство присутствующих на отечественном рынке CRO являются дочерними компаниями больших международных исследовательских объединений. По оценкам ЕБА, украинские компании занимают 15-20% рынка клинических испытаний, в основном они занимаются предрегистрационными исследования (подтверждением качества лекарственных средств перед их регистрацией в стране).
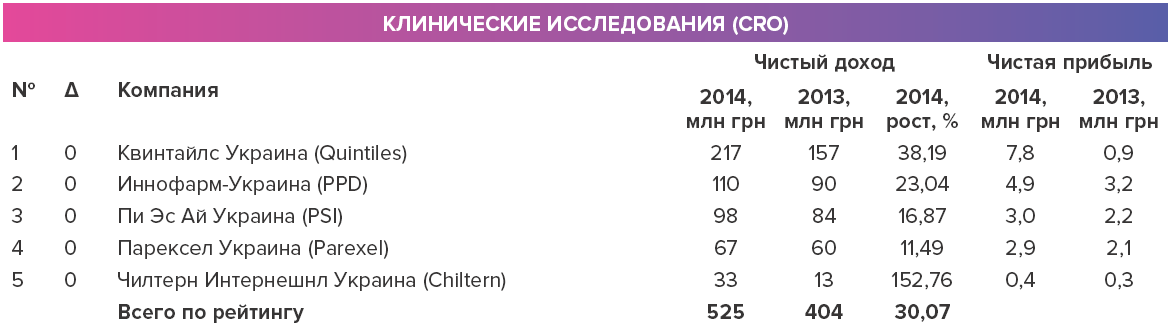
"Основные игроки — это крупные международные компании, такие как Parexel, PPD, Quintiles. Насколько мне известно, есть только одна сугубо украинская компания, которая проводит серьезные клинические исследования — это компания "Фармакси", — отмечает Артем Штангеев, руководитель отдела регистрации и клинических исследований Агентства медицинского маркетинга. Часто фармацевтические компании обращаются одновременно к нескольким подрядчикам для дальнейшего сравнения результатов.
По данным Государственного экспертного центра Минздрава Украины, если в 1996 году ведомство выдало 79 позитивных заключений о проведении клинических испытаний, то в 2015-м — 202
За свои услуги CRO получают от нескольких десятков тысяч до нескольких миллионов евро в зависимости от фазы клинического исследования, поставленных задач, дизайна исследования, изучаемой патологии и длительности испытания.
"Рандомизированные, плацебо-контролируемые, двойные слепые исследования могут стоить более 1 млн евро. В этой сумме велика доля сопутствующих платежей (логистика, лабораторные анализы и обследование, страховка, гонорары врачей и др.), — приводит пример директор "АММ" Юрий Чертков. — Исследования поздних фаз, постмаркетинговые исследования и регистры могут быть выполнены за 20-30 тыс. евро".
Гонорар врача также зависит от дизайна исследования, это может быть 300 грн за визит и 1 тыс. евро в год за одного пациента. В то же время пациенту не оплачивают участие в исследовании, он получает лишь бесплатный доступ к дорогостоящему комплексу лечения и обследования. Согласно оценке главы Государственного экспертного центра Татьяны Талаевой, стоимость получаемых ими во время клинических испытаний инновационных лекарств составляет около 700 млн грн в год.
Если рассматривать структуру проводимых в Украине клинических испытаний в разрезе медицинских направлений, то чаще всего тестируются лекарства из следующих сфер: онкология, психоневрология, кардиология и гастроэнтерология. "При этом наибольшая доля среди всех проводимых испытаний принадлежит к проектам III фазы. Среди клинических тестирований, проводимых украинскими производителями, распространенными являются так называемые сравнительные предрегистрационные исследования, то есть проекты II фазы. Исследования I фазы — наиболее опасные — почти не проводятся в Украине", — рассказывает Андрей Цилицкий.
Место на карте
Украина является более чем привлекательным местом для проведения клинических испытаний: большая страна с достаточно квалифицированным медицинским персоналом, в частности врачами, которые имеют сертификат GCP и опыт участия в клинических исследованиях. "Сильные стороны Украины — высокая квалификация врачей и их готовность выполнять достаточно жесткие требования при проведении клинических исследований за небольшие деньги (по сравнению с гонораром западного врача)", — отмечает Артем Штангеев, Также преимуществом является то, что отечественное законодательство, регулирующее проведение клинических испытаний, в значительной степени гармонизировано с европейскими законодательными нормами.
Но, как отмечает Юрий Лебедь, свой потенциал наша страна использует лишь на 10-15%. "Если сравнивать с западными странами, то количество исследований на душу населения просто ничтожно", — констатирует он. Так, если в Швейцарии проводится 3,98 клинических испытаний на 100 тыс. населения, в США — 2,11, а в Чехии — 1,95, то в Украине этот показатель равен всего 0,61.
Мешает развитию рынка клинических испытаний в Украине, как ни странно, низкая покупательная способность. "Международным фармкомпаниям неинтересно изучать инновационные препараты в той стране, в которой она не планирует их продавать", — отмечает Юрий Чертков.
Объем украинского рынка клинических испытаний составляет около $300 млн
Не облегчает жизнь фармацевтов и более длительная и громоздкая процедура одобрения клинического исследования по сравнению с другими западными странами, в результате старт исследования в Украине может отставать от старта исследования в другой стране. "Продолжительность стартапа клинического испытания в Украине (время от принятия решения в компании о его проведении до привлечения первого пациента) достигает в среднем 251 дня. Для сравнения, в Польше этот показатель составляет 160 дней, в США — 76", — рассказывает Сергей Михайлов, глава подразделения клинических исследований представительства Pfizer HCP Corporation.
"Чтобы повысить привлекательность Украины как места проведения клинических исследований, необходимо ускорить одобрение заявок на проведение тестов, устранить таможенные и налоговые барьеры. Если это произойдет, мы можем получить взрывной рост количества испытаний в стране", — резюмирует Юрий Лебедь.
Источник: delo.ua